您当前的位置:技术平台 > 细胞生物学平台 >
细胞生物学平台
细胞生物学平台可提供多种原代细胞培养、常规细胞系及肿瘤细胞系培养,系统的开展生命科学领域的基础和应用方向的研究,具备整体万级和局部百级的洁净区的实验环境,配备光学显微镜、荧光显微镜、激光共聚焦、超净工作台,细胞培养箱,液氮罐,超低温冰箱等基础设施。此外,还拥有荧光倒置显微镜、活细胞工作站,可集细胞培养、电生理记录、形态观测和荧光信号记录为一体,模仿活细胞的生活环境,实现细胞的长时间培养、连续观察细胞反应和显微操作;拥有流式细胞仪,可快速测量、显示细胞的一系列重要的生物物理、生物化学方面的特征参量
『 实验技术 』
-
 全/核/膜蛋白提取 目前最常用的方法是利用溶液法进行蛋白提取(如 RIPA 裂解液),但由于细胞中的蛋白分为RIPA可溶性和RIPA不可溶性组分,不可溶性组分通常会被直接丢弃忽略,所以溶液法提取的并非完整的总蛋白,而仅仅是一些可溶性蛋白。这里介绍的柱式法,是新一代超快速蛋白质提取方法,只需加入裂解液,过柱离心,不产生不可溶组份,即可提取完整的总蛋白。 查看详情
全/核/膜蛋白提取 目前最常用的方法是利用溶液法进行蛋白提取(如 RIPA 裂解液),但由于细胞中的蛋白分为RIPA可溶性和RIPA不可溶性组分,不可溶性组分通常会被直接丢弃忽略,所以溶液法提取的并非完整的总蛋白,而仅仅是一些可溶性蛋白。这里介绍的柱式法,是新一代超快速蛋白质提取方法,只需加入裂解液,过柱离心,不产生不可溶组份,即可提取完整的总蛋白。 查看详情 肿瘤细胞耐药株构建 药物浓度递增法又称逐步诱导法或小剂量逐步增加剂量持续给药法。该方法是将化疗药物从低浓度开始,逐渐增加药物浓度。将肿瘤细胞培养于该培养基中诱导,直至产生耐药性。该方法建立的细胞系耐药性稳定可靠,诱导所需时间短, 建立的耐药细胞株在冻存或撤药后仍有较高的耐药性,且耐药倍数大于大剂量冲击法,但其建立的耐药模型的增殖能力较低。 查看详情
肿瘤细胞耐药株构建 药物浓度递增法又称逐步诱导法或小剂量逐步增加剂量持续给药法。该方法是将化疗药物从低浓度开始,逐渐增加药物浓度。将肿瘤细胞培养于该培养基中诱导,直至产生耐药性。该方法建立的细胞系耐药性稳定可靠,诱导所需时间短, 建立的耐药细胞株在冻存或撤药后仍有较高的耐药性,且耐药倍数大于大剂量冲击法,但其建立的耐药模型的增殖能力较低。 查看详情 -
 细胞冻存和复苏实验 细胞冻存及复苏的基本原则是慢冻快融,实验证明这样可以最大限度的保存细胞活力。目前细胞冻存多采用甘油或二甲基亚砜作保护剂,这两种物质能提高细胞膜对水的通透性,加上缓慢冷冻可使细胞内的水分渗出细胞外,减少细胞内冰晶的形成,从而减少由于冰晶形成造成的细胞损伤。复苏细胞应采用快速融化的方法,这样可以保证细胞外结晶在很短的时间内即融化,避免由于缓慢融化使水分渗入细胞内形成胞内再结晶对细胞造成损伤。 查看详情
细胞冻存和复苏实验 细胞冻存及复苏的基本原则是慢冻快融,实验证明这样可以最大限度的保存细胞活力。目前细胞冻存多采用甘油或二甲基亚砜作保护剂,这两种物质能提高细胞膜对水的通透性,加上缓慢冷冻可使细胞内的水分渗出细胞外,减少细胞内冰晶的形成,从而减少由于冰晶形成造成的细胞损伤。复苏细胞应采用快速融化的方法,这样可以保证细胞外结晶在很短的时间内即融化,避免由于缓慢融化使水分渗入细胞内形成胞内再结晶对细胞造成损伤。 查看详情 细胞传代培养实验 体外培养的原代细胞或细胞株要在体外持续地培养就必须传代,以便获得稳定的细胞株或得到大量的同种细胞,并维持细胞种的延续。培养的细胞形成单层汇合以后,由于密度过大生存空间不足而引起营养枯竭,将培养的细胞分散,从容器中取出,以1:2 或l:3 以上的比率转移到另外的容器中进行培养,即为传代培养。 细胞一代:指从细胞接种到分离再培养的一段期间,与细胞世代或倍增不同。在一代中,细胞培增3~6 次。细胞传代后,一般经过三个阶段:游离期、指数增生期和停止期。常用细胞分裂指数表示细胞增殖的旺盛程度,即细胞群的分裂相数/100 个细胞。一般细胞分裂指数介于0.2%~0.5%,肿瘤细胞可达3~5%。 细胞接种2~3 天分裂增殖旺盛,是活力最好时期,称指数增生期(对数生长期),适宜进行各种实验。 查看详情
细胞传代培养实验 体外培养的原代细胞或细胞株要在体外持续地培养就必须传代,以便获得稳定的细胞株或得到大量的同种细胞,并维持细胞种的延续。培养的细胞形成单层汇合以后,由于密度过大生存空间不足而引起营养枯竭,将培养的细胞分散,从容器中取出,以1:2 或l:3 以上的比率转移到另外的容器中进行培养,即为传代培养。 细胞一代:指从细胞接种到分离再培养的一段期间,与细胞世代或倍增不同。在一代中,细胞培增3~6 次。细胞传代后,一般经过三个阶段:游离期、指数增生期和停止期。常用细胞分裂指数表示细胞增殖的旺盛程度,即细胞群的分裂相数/100 个细胞。一般细胞分裂指数介于0.2%~0.5%,肿瘤细胞可达3~5%。 细胞接种2~3 天分裂增殖旺盛,是活力最好时期,称指数增生期(对数生长期),适宜进行各种实验。 查看详情 -
 细胞计数实验 细胞悬液制备后,需要计算悬液中所含细胞数量;一般以细胞数/毫升表示。因只有健康的细胞才有活力,接种后能够生长增殖,所以在接种关应先检查一下细胞的活力。 查看详情
细胞计数实验 细胞悬液制备后,需要计算悬液中所含细胞数量;一般以细胞数/毫升表示。因只有健康的细胞才有活力,接种后能够生长增殖,所以在接种关应先检查一下细胞的活力。 查看详情 Transwell细胞侵袭实验 Transwell是一类有通透性的杯状的装置,放入培养板后,分为两室:Transwell小室内称上室,盛装上层培养液;培养板内称下室,盛装下层培养液。上下层培养液以聚碳酸酯膜相隔,以此研究下层培养液中的成分对细胞生长、运动等的影响。Transwell检测技术服务,用于测定细胞迁移及侵袭。 细胞体外侵袭实验主要应用于各种细胞因子对恶性肿瘤细胞侵袭和转移的影响及一些抑制血管生成的新药研究,但在具体实验中获得真实、最佳实验结果的图像,并借以说明问题并非简单。 查看详情
Transwell细胞侵袭实验 Transwell是一类有通透性的杯状的装置,放入培养板后,分为两室:Transwell小室内称上室,盛装上层培养液;培养板内称下室,盛装下层培养液。上下层培养液以聚碳酸酯膜相隔,以此研究下层培养液中的成分对细胞生长、运动等的影响。Transwell检测技术服务,用于测定细胞迁移及侵袭。 细胞体外侵袭实验主要应用于各种细胞因子对恶性肿瘤细胞侵袭和转移的影响及一些抑制血管生成的新药研究,但在具体实验中获得真实、最佳实验结果的图像,并借以说明问题并非简单。 查看详情 -
 细胞划痕实验 创伤愈合实验是一种简单、廉价的方法,也是最早发展起来的研究定向细胞在体外迁移的方法之一。该方法模拟了细胞在体内愈合过程中的迁移过程。基本步骤包括在细胞单层中创建一个“伤口”,在细胞迁移过程中在开始和定期捕获图像以关闭伤口,以及比较图像以确定细胞迁移速率。 查看详情
细胞划痕实验 创伤愈合实验是一种简单、廉价的方法,也是最早发展起来的研究定向细胞在体外迁移的方法之一。该方法模拟了细胞在体内愈合过程中的迁移过程。基本步骤包括在细胞单层中创建一个“伤口”,在细胞迁移过程中在开始和定期捕获图像以关闭伤口,以及比较图像以确定细胞迁移速率。 查看详情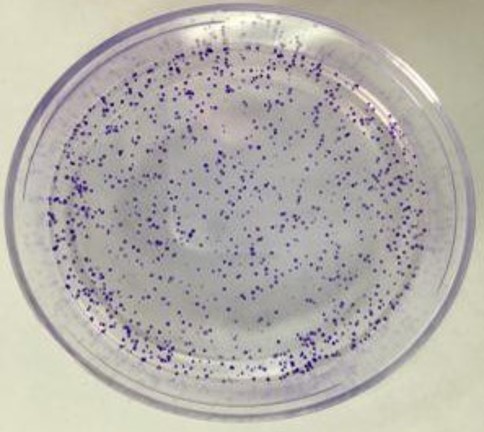 细胞集落实验 细胞集落形成实验是检测培养细胞增殖能力的有效方法之一。由于它是通过检验活细胞的增殖能力,因此避免了在生长曲线绘制时将死细胞或不能再分裂细胞计数在内而导致的实验结果误差。 细胞集落形成实验的原理是单个细胞在体外持续增殖6代以上,其后代形成一个细胞群体,称为集落(colony)。每个克隆均包含50个细胞以上,大小在0.3~1.0 mm之间。通过计算集落形成率(colony forming efficiency),来测定测试细胞的增殖能力。 查看详情
细胞集落实验 细胞集落形成实验是检测培养细胞增殖能力的有效方法之一。由于它是通过检验活细胞的增殖能力,因此避免了在生长曲线绘制时将死细胞或不能再分裂细胞计数在内而导致的实验结果误差。 细胞集落形成实验的原理是单个细胞在体外持续增殖6代以上,其后代形成一个细胞群体,称为集落(colony)。每个克隆均包含50个细胞以上,大小在0.3~1.0 mm之间。通过计算集落形成率(colony forming efficiency),来测定测试细胞的增殖能力。 查看详情 -
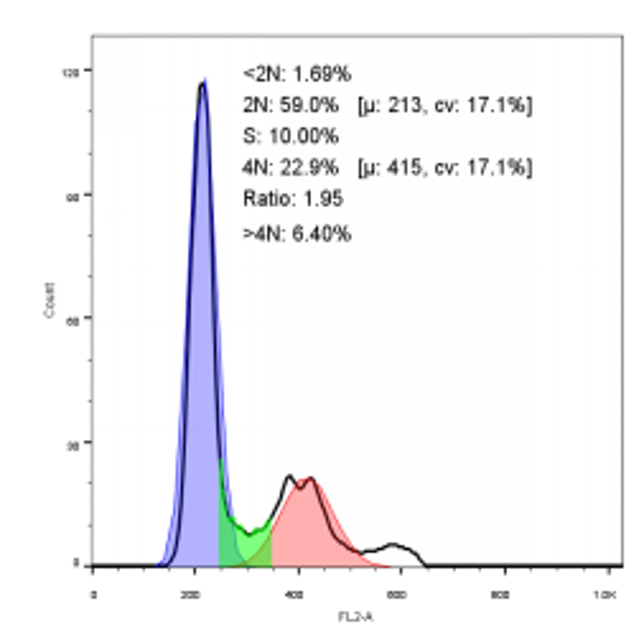 流式细胞实验 活细胞表面保留有较完整的抗原 或受体,先用特异性鼠源性单克隆抗体与细胞表面相应抗原结合,再用荧光标记的第二抗体结合,根据所测定的荧光强度和阳性百分率即可知相应抗原的密度和分布。 查看详情
流式细胞实验 活细胞表面保留有较完整的抗原 或受体,先用特异性鼠源性单克隆抗体与细胞表面相应抗原结合,再用荧光标记的第二抗体结合,根据所测定的荧光强度和阳性百分率即可知相应抗原的密度和分布。 查看详情 MTT实验 活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO )能溶解细胞中的甲瓒,用酶标仪在490nm波长处测定其光吸收值,在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。根据测得的吸光度值(OD值),来判断活细胞数量,OD值越大,细胞活性越强(如果是测药物毒性,则表示药物毒性越小)。 查看详情
MTT实验 活细胞线粒体中的琥珀酸脱氢酶能使外源性MTT还原为水不溶性的蓝紫色结晶甲瓒(Formazan)并沉积在细胞中,而死细胞无此功能。二甲基亚砜(DMSO )能溶解细胞中的甲瓒,用酶标仪在490nm波长处测定其光吸收值,在一定细胞数范围内,MTT结晶形成的量与细胞数成正比。根据测得的吸光度值(OD值),来判断活细胞数量,OD值越大,细胞活性越强(如果是测药物毒性,则表示药物毒性越小)。 查看详情 -
 原代细胞培养 原代培养是直接从生物体获取细胞进行培养,由于细胞刚刚从活体组织分离出来,故更接近于生物体内的生活状态。这一方法可为研究生物体细胞的生长、代谢、繁殖提供有力的手段,同时也为以后传代培养创造条件。最常用的原代培养有组织块培养和分散细胞培养。组织块培养是将剪碎的组织块直接移植在培养瓶壁上,加入培养基后进行培养。分散细胞培养则是将组织块用机械法或化学法使细胞分散。从胎儿或新生儿的组织分离到活性最好的游离细胞,经典的方法是用蛋白水解酶(如胰蛋白酶和胶原酶)消化细胞间的结合物,或用金属离子螯合剂(如EDTA)除去细胞互相粘着所依赖的Ca2+,再经机械轻度振荡,使之成为单细胞。 查看详情
原代细胞培养 原代培养是直接从生物体获取细胞进行培养,由于细胞刚刚从活体组织分离出来,故更接近于生物体内的生活状态。这一方法可为研究生物体细胞的生长、代谢、繁殖提供有力的手段,同时也为以后传代培养创造条件。最常用的原代培养有组织块培养和分散细胞培养。组织块培养是将剪碎的组织块直接移植在培养瓶壁上,加入培养基后进行培养。分散细胞培养则是将组织块用机械法或化学法使细胞分散。从胎儿或新生儿的组织分离到活性最好的游离细胞,经典的方法是用蛋白水解酶(如胰蛋白酶和胶原酶)消化细胞间的结合物,或用金属离子螯合剂(如EDTA)除去细胞互相粘着所依赖的Ca2+,再经机械轻度振荡,使之成为单细胞。 查看详情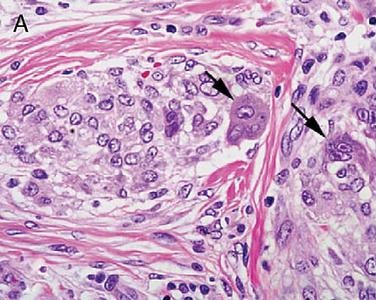 细胞免疫组化实验 抗体和抗原之间的结合具有高度的特异性,免疫组织化学正是利用了这一原理。先将组织或细胞中的某种化学物质提取出来,以此作为抗原或半抗原,通过免疫动物后获得特异性的抗体,再以此抗体去探测组织或细胞中的同类的抗原物质。由于抗原与抗体的复合物是无色的,因此还必须借助于组织化学的方法将抗原抗体结合的部位显示出来,以期达到对组织或细胞中的未知抗原进行定性,定位或定量的研究。 查看详情
细胞免疫组化实验 抗体和抗原之间的结合具有高度的特异性,免疫组织化学正是利用了这一原理。先将组织或细胞中的某种化学物质提取出来,以此作为抗原或半抗原,通过免疫动物后获得特异性的抗体,再以此抗体去探测组织或细胞中的同类的抗原物质。由于抗原与抗体的复合物是无色的,因此还必须借助于组织化学的方法将抗原抗体结合的部位显示出来,以期达到对组织或细胞中的未知抗原进行定性,定位或定量的研究。 查看详情